6月25日,国际学术期刊《Insect Biochemistry and Molecular Biology》在线发表了中心最新研究成果“Trypsin-type serine protease p37k hydrolyzes CPAP3-type cuticle proteins in the molting fluid of the silkworm Bombyx mori”,该研究鉴定并证明了p37k蛋白酶参与降解家蚕CPAP3型表皮蛋白。

昆虫是世界上种类最多,数量最大,分布最广的动物。昆虫的表皮主要由几丁质,蛋白质和少量脂类组成,覆盖整个体表,不仅给昆虫提供了一个稳定的内环境防止水分的过度蒸发以及保护其免受外源性病原体的入侵,而且在昆虫变态发育过程中对其塑型以及维持正常的生理功能是必不可少的,表皮蛋白在其中发挥着重要的作用。在昆虫的蜕皮过程中,表皮蛋白会与几丁质相互作用形成一个稳定的表皮结构,并且表皮蛋白会随着昆虫的蜕皮而进行更新。表皮蛋白在昆虫中具有很高的同源性,主要分为12类,目前研究最多的是含有R&R结构域的CPR家族和含有ChtBD2结构域的CPAP家族。利用生物技术等手段从分子与生化水平了解表皮结构与蜕皮过程,有利于进一步了解昆虫的变态发育与进化,对寻找鳞翅目昆虫表皮与病原微生物防治的相关基因和新靶标具有重要意义。
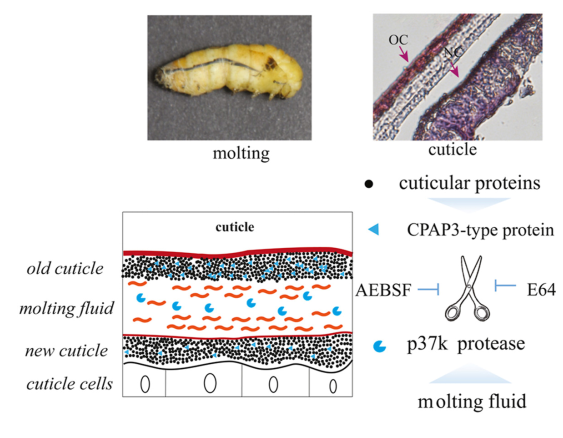
围食膜因子相似蛋白(CPAP3)是一种具有三个几丁质结合域(CBDs)的蛋白家族,它们通过与几丁质结合,在表皮的形成中起重要作用。在之前的研究中,该课题组从家蚕基因组中鉴定了多种CPAP3型表皮蛋白,其中CPAP3-A2 (BmCBP1)在表皮中高表达。本研究,为了阐明CPAP3型表皮蛋白的消化机制,作者将BmCBP1与蜕皮液体外孵育,发现其水解受到丝氨酸蛋白酶和半胱氨酸蛋白酶抑制剂的抑制,对天然纯化的蜕皮液进行LC-MS/MS分析,推测是一种胰蛋白酶型丝氨酸蛋白酶p37k负责水解BmCBP1。随后利用Bac-to-Bac表达系统重组表达p37k,发现在其活性形式下,重组p37k可以成功水解BmCBP1。作者进一步分析BmCBP1的消化位点,将BmCBP1的169位精氨酸突变为丙氨酸,结果与正常BmCBP1相比,p37k对突变体BmCBP1的水解作用减弱。该研究发现了一种胰蛋白酶型丝氨酸蛋白酶参与了CPAP3型表皮蛋白的降解,揭示了p37k在蜕皮过程中的重要作用。这些发现为进一步阐明昆虫蜕皮和变态的机制提供了依据,同时对林业害虫的防治以及未来新型环保农药的开发奠定理论基础。此外,该课题组还在继续关注表皮降解与再生的机制,并对p37k在变态过程中的作用进行详细分析。
侯勇教授和硕士研究生杨领振为论文共同第一作者,夏庆友教授为通讯作者,西南大学为第一完成单位。本研究得到了国家自然科学基金项目、重庆市自然科学基金项目、重庆市教育委员会项目的支持。
论文链接:https://linkinghub.elsevier.com/retrieve/pii/S096517482100093X